
4. परमाणु की संरचना
प्रश्न 1. केनाल किरणें क्या हैं?
उत्तर: केनाल किरणें धनावेशित विकिरण होती हैं। इनके द्वारा अंततः दूसरे अवपरमाणुक तत्त्वों की खोज हुई। धनावेशित कणों का आवेश इलेक्ट्रॉनों के आवेश के बराबर किन्तु विपरीत होता है। इनका द्रव्यमान इलेक्ट्रॉनों की अपेक्षा लगभग 2000 गुणा अधिक होता है। इनको प्रोटॉन कहते हैं। केनाल किरणों की खोज ई. गोल्डस्टीन ने 1886 में की।
प्रश्न 2. यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं ?
उत्तर: नहीं, परमाणु पर कोई आवेश नहीं होगा क्योंकि प्रोटॉन व इलेक्ट्रॉन के आवेश संतुलित होंगे। इलेक्ट्रॉन व प्रोटॉन का आवेश एक-दूसरे के बराबर किन्तु विपरीत होता है।
प्रश्न 3. परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर: टॉमसन के परमाणु मॉडल के आधार पर –
1. परमाणु धनावेशित गोले का बना होता है और इलेक्ट्रॉन उसमें फँसे होते हैं।
2. ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं। अतः टॉमसन का मॉडल परमाणु के उदासीन होने की व्याख्या करता है।
प्रश्न 4. रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है ?
उत्तर: रदरफोर्ड के परमाणु मॉडल के अनुसार परमाणु के नाभिक में धनावेशित कण विद्यमान है।
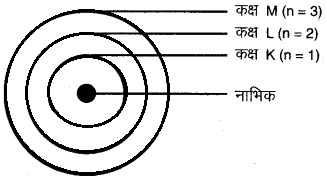
प्रश्न 5. तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
उत्तर:
प्रश्न 6. क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से सम्भव होगा?
उत्तर: यदि अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त किसी दूसरी धातु की पन्नी से किया जायेगा तो प्रयोग सफल नहीं होगा व सटीक निष्कर्ष नहीं निकलेगा। अन्य धातु की परत इतनी पतली नहीं होती। मोटी परत वाली पन्नी लेने पर अधिक अल्फा कण विक्षेपित होंगे व परमाणु में धनावेशित भाग की स्थिति का निश्चित रूप से अनुमान लगाना कठिन होगा।
Parmanu Ki Sanrachna Class 9th Science Notes in Hindi
प्रश्न 7. परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर: परमाणु के तीन अवपरमाणुक कण हैं- इलेक्ट्रॉन, प्रोटॉन एवं न्यूट्रॉन।
प्रश्न 8. हीलियम परमाणु का परमाणु द्रव्यमान 4u है और इसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर: परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन के द्रव्यमान के योग के बराबर होता है।
हीलियम परमाणु का परमाणु द्रव्यमान = 4u
हीलियम के नाभिक में उपस्थित प्रोटॉन = 2
अतः इसमें उपस्थित न्यूट्रॉन का द्रव्यमान = 40 = 2u
इसमें उपस्थित न्यूट्रॉन = 2
प्रश्न 9. कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए।
उत्तर: कार्बन परमाणु में कुल इलेक्ट्रॉनों की संख्या 6 है।
कार्बन परमाणु में इलेक्ट्रॉन वितरण–
पहला K कोश = 2 इलेक्ट्रॉन
दूसरा L कोश = 4 इलेक्ट्रॉन
या कार्बन परमाणु में इलेक्ट्रॉन वितरण 2, 4 है।
सोडियम परमाणु में कुल इलेक्ट्रॉन 11 हैं।
सोडियम परमाणु में इलेक्ट्रॉन वितरण –
प्रथम K कोश = 2 इलेक्ट्रॉन
दूसरा L कोश = 8 इलेक्ट्रॉन
तीसरा M कोश = 1 इलेक्ट्रॉन
अतः सोडियम में इलेक्ट्रॉन वितरण 2, 8, 1 है।
प्रश्न 10. यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है ?
(b) परमाणु का क्या आवेश है ?
उत्तर:
(a) परमाणु की परमाणुक संख्या उसमें उपस्थित – प्रोटॉनों की संख्या के बराबर होती है। अत: परमाणु की परमाणुक संख्या 8 है।
(b) चूँकि इलेक्ट्रॉनों व प्रोटॉनों की संख्या बराबर है। अतः परमाणु का आवेश शून्य होगा या परमाणु अनावेशित होगा।
प्रश्न 11. समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर: 1C6 व 14C6 समस्थानिक हैं। इनका इलेक्ट्रॉनिक विन्यास समान है– 2, 4.
22Ne10 व 22N11 समभारिक हैं। इनकी द्रव्यमान संख्या समान व परमाणु संख्या भिन्न है – (10 व 11)। इनके इलेक्ट्रॉनिक विन्यास हैं –
22N10 – 2, 8
22N11 – 2, 8, 1
प्रश्न 12. सूखे बालों पर कंघी कीजिए। क्या कंघी कागज के छोटे-छोटे टुकड़ों को आकर्षित करती है ?
उत्तर: सूखे बालों पर कंघी करने पर कंघी पर ऋणावेश उत्पन्न हो जाता है क्योंकि बालों से इलेक्ट्रॉन कंघी में स्थानान्तरित हो जाते हैं। जब कंघी को कागज के छोटे-छोटे टुकड़ों के पास लाया जाता है तो कागज (जो पहले अनावेशित था) पर कंघी के पास वाले सिरे पर धनात्मक आवेश उत्पन्न हो जाता है। कागज के दूसरे सिरे पर ऋणात्मक आवेश उत्पन्न होता है। चूँकि विपरीत आवेश एक-दूसरे को आकर्षित करते हैं अतः कागज के टुकड़े कंघी की ओर आकर्षित हो जाते हैं।
प्रश्न 13. काँच की एक छड़ को सिल्क के कपड़े पर रगड़िए और इस छड़ को हवा से भरे गुब्बारे के पास लाइए। क्या होता है, ध्यान से देखिए।
उत्तर: काँच की छड़ को सिल्क से रगड़ने पर इसमें धनात्मक आवेश उत्पन्न हो जाता है व सिल्क के कपड़े पर ऋणात्मक आवेश उत्पन्न होता है। जब काँच की छड़ को हवा से भरे गुब्बारे के पास लाया जाता है तो यह गुब्बारे को आकर्षित करती है क्योंकि गुब्बारा ऋणावेशित हो जाता है।
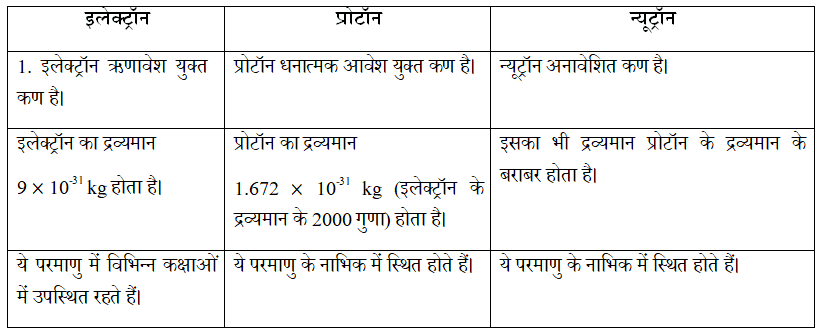
प्रश्न 14. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर:
प्रश्न 15. जे. जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर: जे. जे. टॉमसन का परमाणु मॉडल दूसरे वैज्ञानिकों द्वारा किये गये प्रयोगों के परिणामों को नहीं समझा सका। इसको किसी प्रयोग द्वारा स्थापित नहीं किया गया।
प्रश्न 16. रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर: रदरफोर्ड के परमाणु मॉडल से परमाणु की स्थिरता की व्याख्या नहीं की जा सकती।
Parmanu Ki Sanrachna Class 9th Science Notes in Hindi
प्रश्न 17. बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर: नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत की
1. परमाणु का केन्द्र धनावेशित होता है जिसे नाभिक कहा जाता है। एक परमाणु का लगभग सम्पूर्ण द्रव्यमान नाभिक में होता है।
2.नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।
3. नाभिक के चारों ओर इलेक्ट्रॉन कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं।
4. जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का. विकिरण नहीं होता है। इन कक्षाओं (या कोशों) को ऊर्जा स्तर कहते हैं।
5. ये कक्षाएँ (या कोश) K, L, M, N……..या संख्याओं, 1, 2, 3, 4…. के द्वारा दिखाई जाती है, जैसाकि चित्र 2 में दिखाया गया है।

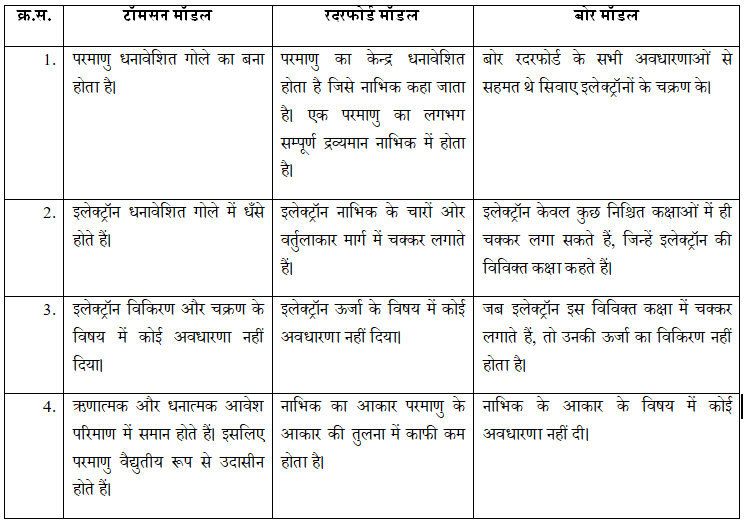
प्रश्न 18. इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर:
प्रश्न 19. सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर: परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है, वही उस तत्त्व की संयोजकता-शक्ति अर्थात संयोजकता होती है। संयोजकता परमाणु की संयोजन शक्ति है। सिलिकॉन (Si) का इलेक्ट्रॉनिक विन्यास 2, 8, 4 है। अतः सिलिकॉन की संयोजकता 4 होगी क्योंकि उसे अष्टक पूर्ण करने के लिए 4 इलेक्ट्रॉन साझा करने पड़ेंगे। ऑक्सीजन (O) का इलेक्ट्रॉनिक विन्यास 2, 6 है। अतः ऑक्सीजन की संयोजकता 2 होगी क्योंकि उसे अपना अष्टक बनाने के लिए 2 इलेक्ट्रॉन लेने पड़ेंगे।
प्रश्न 20. उदाहरण के साथ व्याख्या कीजिए—परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर: परमाणु संख्या- एक परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या को परमाणु कहते हैं। इसे Z के द्वारा दर्शाया जाता है। किसी तत्त्व के सभी अणुओं की परमाणु संख्या (Z) समान होती है। हाइड्रोजन के लिए Z = 1, क्योंकि हाइड्रोजन परमाणु के नाभिक में केवल एक प्रोटॉन होता है।
द्रव्यमान संख्या- एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या के योग को द्रव्यमान संख्या कहा जाता है। उदाहरण के लिए कार्बन का द्रव्यमान 12 u है क्योंकि इसमें 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं, 6u+6u= 12 इसी प्रकार, ऐलुमिनियम का द्रव्यमान 27 u है (13 प्रोटॉन + 14 न्यूट्रॉन)।
समस्थानिक- समस्थानिक एक ही तत्त्व के परमाण होते हैं। जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है। उदाहरण के लिए, हाइड्रोजन परमाणु की तीन परमाण्विक स्पीशीज होती हैं-प्रोटियम H, ड्यूटीरियम (TH या D), ट्राइटियम (H या T)। प्रत्येक की परमाणु संख्या समान है लेकिन द्रव्यमान संख्या क्रमशः 1, 2 और 3 है।
समभारिक- समभारिक वे परमाणु हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है। दो तत्त्वों-कैल्शियम, परमाणु संख्या 20 और आर्गन परमाणु संख्या 18 में परमाणु संख्या भिन्न है लेकिन उनकी द्रव्यमान संख्या 40 यानि कि समान है।
समस्थानिकों के अनुप्रयोग –
1. यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी (atomic reactor) में ईंधन के रूप में होता है।
2. कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है।
Parmanu Ki Sanrachna Class 9th Science Notes in Hindi
Read more – Click here
YouTube Video – Click here
Leave a Reply